私たちは最近DHMEQがNF-κBの特定の場所に直接結合して、その活性を阻害することを解明しました。
ほかのタンパク質には結合しないので、ほかのNF-κB阻害剤と比べて選択性に優れています。
動物などへの毒性も低いことになります。
タンパク質は20個のアミノ酸がいろいろな組み合わせでつながってできあがっています。タンパク質には小さいもので50個、大きいものでは数千個のアミノ酸が使われています。
NF-κBは、5つあるRelファミリータンパク質の2つが結合している構造です。Relファミリータンパク質はp65,cRel,RelB,p50,p52の5つでそれぞれ共通構造を持ち、どれも数百のアミノ酸からできています。
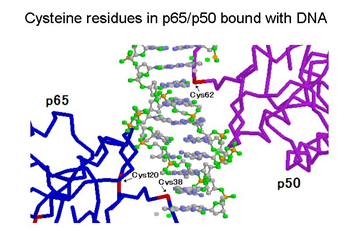
アミノ酸のひとつに「システイン」とよばれるイオウを含んだものがあります。最近、私たちの研究からDHMEQはp65, cRel, RelB, p50のそれぞれのただひとつのシステインに結合することがわかりました。(p52には結合しません)
ひとつのタンパク質に、たくさんのシステインがあるのですが、DHMEQはそのうちのひとつを選んで不可逆的に結合します。NF-κBは転写因子なのでDNAに結合します。
DNAと結合した時の分子モデルをみると、DHMEQはp65, cRel, RelBまたはp50の、DNAのすぐ近くにあるひとつのシステインに結合します。
そのことからDHMEQはNF-κBをDNAに結合させなくする、これが阻害の機構であることがわかりました。
1分子のNF-κB構成因子に1分子のDHMEQが不可逆的に結合して活性阻害します。
このことはノーベル賞受賞の田中耕一博士が発見したMALDI-TOF MSというタンパク質の重さを精密に測定する分析法でわかりました。
P65に1:1でDHMEQを反応させるとp65の分子量がちょうどDHMEQの重さ分だけ増えるのです。
この優れた物理化学的方法でNF-κBとの特異的結合が証明できたのはたくさんのNF-κB阻害剤のなかでDHMEQだけだと思います。
これはDHMEQのNF-κBへの結合が非常に特異的だからと考えられます。
このようにDHMEQは物理化学的に証明された特異的NF-κB阻害剤なのです。